近幾十年來的研究創新為 mRNA 作為新興疫苗技術的發展奠定了基礎。與傳統疫苗平臺相比,基于 mRNA 的疫苗開發相對于其它類型疫苗的加速得益于其簡單的生產過程和安全性。首先,mRNA 不構成插入誘變的風險。它是非感染性的,并在細胞內自然降解。其次,可以通過修飾和各種遞送方法使 mRNA 更加穩定,使其在宿主細胞中高效且易于翻譯。此外,可以使用體外轉錄 (IVT) 反應在無細胞系統中制備 mRNA,與傳統的基于細胞的疫苗平臺相比,該技術更易于生產和調節。最后,mRNA 生產可以應用于使用類似生物過程的各種抗原,使該技術易于適應和更加通用。
最近的 COVID-19 大流行凸顯了擁有隨時可用的疫苗平臺以應對新興流行病的重要性。為了應對大流行,mRNA 技術是第一個作為 COVID-19 治療藥物進入I期臨床試驗的候選疫苗,疫苗的臨床試驗在序列鑒定后兩個月開始。因此,mRNA 技術被帶到了疫苗療法研究和開發的前沿。強調使用 mRNA 疫苗治療當前和新出現的疾病的前瞻性研究已經推動許多候選疫苗進入各種傳染病的臨床試驗。因此,由于新型 mRNA 疫苗技術帶來的好處和靈活性,人們越來越有興趣在未來幾年推進其工業規模生產。這將涉及增強和優化 mRNA 生物工藝,以適應各種抗原平臺。
本綜述將概述 mRNA 疫苗的設計和 mRNA 疫苗平臺的當前技術發展。此外,文章將側重于疫苗設計、生產和當前實施的關鍵質量屬性范例,以實現高規格 mRNA 疫苗生產的創新。最后,將討論 PAT 集成的生物制藥生產的未來方向和發展。
作為疫苗的 mRNA 的進化
1989 年,一項開創性的研究證明了使用脂質體進行 RNA 轉染可生產蛋白質。不久之后,另一項研究表明,將裸露的 mRNA 注入小鼠肌肉細胞會導致編碼蛋白在體內表達。這些研究確立了使用體外轉錄的 mRNA 在細胞內生產蛋白質的可行性。然而,盡管有這些有希望的發現,但由于對 mRNA 穩定性和翻譯效率的擔憂,使用 RNA 作為治療工具面臨著幾個重大挑戰。因此,它并沒有立即被認為是一種可行的治療選擇。
直到 2000 年代初,修飾核苷酸的技術突破和遞送方法的進步才為 mRNA 作為潛在治療藥物鋪平了道路。許多創新,例如使用修飾的核苷酸、特定密碼子序列以及使用高效液相色譜 (HPLC) 消除雙鏈 RNA 污染物,有助于提高 mRNA 的穩定性,并減輕不需要的免疫原性反應,從而推動了 mRNA 疫苗的開發。此外,細胞質 mRNA 遞送的效率也因各種遞送方法而發生了革命性變化,包括使用脂質納米顆粒 (LNP)。
mRNA抗原的類型
通過體外轉錄 (IVT) 產生的 mRNA 抗原的結構與成熟的真核 mRNA 非常相似。它們包含一個編碼目標抗原的開放閱讀框 (ORF),兩側是 5' 和 3' 非翻譯區 (UTR) 和一個 5' 引物帽結構,以及一個 3' poly(A) 尾部。目前,已經評估了兩種類型的 mRNA 抗原構建體:非復制和自我擴增的 mRNA 抗原。兩者的結構相似,除了自我復制型 mRNA 還包括通常來自單鏈 RNA 病毒的病毒復制酶基因(圖 1)。非復制性 mRNA 抗原由于其 RNA 長度較短和直接抗原表達而更容易生產。然而,由于其表達時間較短,它可能需要更高的劑量才能產生適當的免疫反應。自擴增 mRNA 抗原可以緩解這個問題,因為它攜帶病毒復制酶基因,以增強 mRNA 表達持續時間。然而,由于較長的 RNA 轉錄本長度和自我擴增的潛在免疫反應,目前在生產和優化此類抗原方面仍存在挑戰。研究人員目前正在探索優化 mRNA 抗原表達和穩定性的策略。
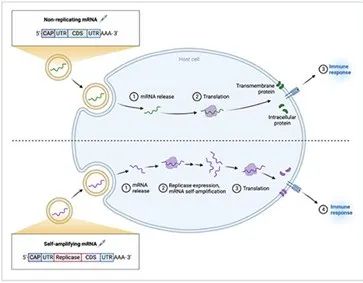
圖1:使用非復制mRNA和自擴增mRNA表達抗原的簡化示意圖。同樣,非復制和自我擴增的RNA都可以用脂質納米顆粒 (LNP) 包裹,以促進細胞攝取,并防止mRNA降解。非復制的mRNA結構體在細胞質中被翻譯,以產生目的蛋白質,此外,自擴增的mRNA也被翻譯,以產生復制酶機制,用于擴增目標蛋白質。所得抗原蛋白以跨膜或細胞內蛋白的形式產生,用于刺激免疫反應。
優化 mRNA 抗原效率
設計有效的 mRNA 候選疫苗需要仔細考慮許多工藝屬性。最近的進展創造了改造 mRNA 技術以創造更適合的 mRNA 疫苗抗原的機會。對于 mRNA 疫苗,有兩個主要成分:mRNA(抗原)(圖 2)和脂質納米顆粒(遞送系統)。這兩個組成部分都需要進行監管,以確保高質量的疫苗生產。
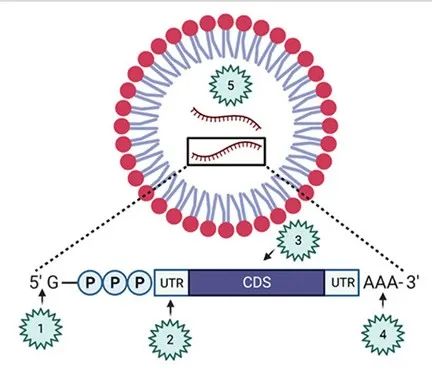
圖2:mRNA抗原設計的關鍵質量屬性。影響轉錄質量、效率和穩定性的mRNA抗原屬性包括[1]5' 帽、[2]非翻譯區、[3]編碼序列、[4]3' Poly(A) 尾、[5]mRNA純度。
mRNA 5'帽:該帽是mRNA抗原的重要組成部分,在調節翻譯起始和免疫原性中起重要作用。有兩種常見的帽狀結構:cap O,由甲基-7鳥嘌呤核苷酸通過5'三磷酸連接到5' 位置;cap 1,涉及核糖2'-O位置的mRNA首核苷酸甲基化。這些帽通過防止外切酶降解來穩定mRNA轉錄物,并提供有效的翻譯起始位點來招募核糖體。此外,加帽mRNA有助于防止先天免疫反應的過度激活。有幾種方法可以將5'帽添加到mRNA轉錄物上。一種方法是在IVT反應中使用合成的帽類似物,而另一種方法涉及使用CleanCap?方法將cap 1結構添加到特定的轉錄起始序列。加帽也可以使用牛痘加帽系統作為酶促反應來完成。這些方法確保了對mRNA抗原的有效和精確的5'加帽,這對于開發有效的疫苗至關重要。
mRNA 5'和3'非翻譯區(UTR's):5'和3'非翻譯區分別對翻譯效率和mRNA穩定性至關重要。優化的序列特異性富集UTR可以通過影響翻譯機器識別、招募和mRNA運輸來促進蛋白質產量。優化可以通過調整3'和5' UTR的長度來實現,或者使用特定的核苷酸富集 (例如,5' UTR Kozak序列用于翻譯效率,3' UTR au豐富元件用于調節轉錄物穩定性)。選擇基于其它天然穩定表達較長的mRNA分子的UTR也有助于提高mRNA的翻譯效率和轉錄物的穩定性。
抗原編碼序列:為了豐富抗原表達,目前使用密碼子優化和組成來提高轉錄效率(如GC含量)。此外,修飾的核苷酸,包括甲基化核苷和假尿嘧啶,可以幫助保護mRNA免受強烈的免疫刺激反應,增加mRNA的穩定性,允許更長的轉錄物表達,并提高疫苗的安全性。
mRNA 3' Poly(A) 尾:3' Poly(A) 尾通過保護序列免受核酸酶降解和為Poly(A) 結合蛋白結合提供位點,對mRNA的穩定性很重要。Poly(A) 尾的最佳長度取決于細胞類型,必須仔細優化以提供最大的穩定性。研究表明,poly(A) 尾的長度與mRNA表達的持續時間之間存在相關性。添加poly(A) 尾的主要方法有兩種。第一種方法是將poly(A) 編碼序列直接添加到用于IVT的DNA模板中。第二種是使用單獨的酶促反應,利用聚A聚合酶。poly (A) 尾的優化對于確保mRNA轉錄物保持完整和功能至關重要,從而提供安全有效的候選疫苗。
mRNA純度:mRNA純度是一項關鍵的質量屬性,必須仔細控制,以確保疫苗效力和最佳免疫反應。RNA污染物激活觸發mRNA降解和抑制翻譯的免疫反應。dsRNA污染物是IVT期間異常聚合酶活性產生的雜質的一種形式。為了減輕這種情況的發生,使用HPLC純化IVT mRNA有助于去除dsRNA,增加蛋白質產量,同時減少不必要的免疫激活。
脂質納米顆粒 (LNP) 遞送mRNA疫苗的優化:為了確保mRNA疫苗的有效性,需要將抗原正確遞送到細胞中,以表達目的蛋白質。雖然裸mRNA可以在不同的細胞類型中整合和表達,但最佳表達需要一種遞送機制。這不僅有助于正確地遞送mRNA,以產生抗原,而且還保護其免受核酸酶的降解。在各種遞送系統中,目前LNP已廣泛用于疫苗開發,包括COVID-19 mRNA疫苗。大多數LNP配方含有陽離子或電離脂質以及磷脂、膽固醇和聚乙二醇(PEG)脂質。每種類型的脂質在調節細胞細胞質中mRNA抗原顆粒的穩定性、有效性和生物分布方面發揮著不同的作用,可電離脂質有助于內體從中性pH值轉換為酸性pH值,這對于細胞攝取后mRNA的釋放很重要。其它脂質,包括磷脂,如1,2-二硬脂酰-sn-甘油-3磷脂膽堿 (DSC)和DOPE,有助于穩定LNP結構,并有助于脂質納米顆粒的內體釋放。此外,膽固醇促進LNP結構的完整性,從而促進細胞有效攝取。最后,聚乙二醇化脂質通過延長納米顆粒在血液中的循環,以促進細胞攝取和減少聚集,從而增強LNP的穩定性。因此,mRNA和LNP遞送系統的屬性和成分在mRNA疫苗產品的生產過程中是調節和控制抗原產量和質量的關鍵考慮因素。
mRNA生產的演變和未來展望
mRNA疫苗生產概述
目前的mRNA生產過程可分為三個不同的階段:1- mRNA活性物質的生產,2- RNA-LNP的配制,3-終產品的生產。
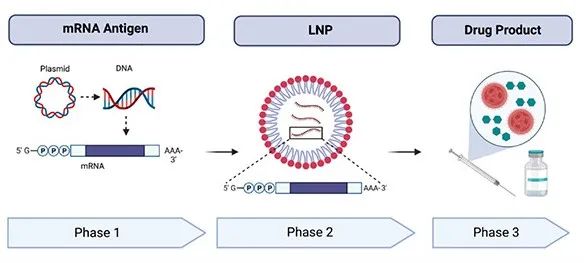
圖3:mRNA疫苗生產的主要工藝階段概述:1-mRNA活性物質的生產,2-RNA-脂質納米顆粒的制劑,3-終產品的生產。
階段 1: mRNA 活性物質的產生
上游 mRNA 平臺過程通常涉及使用大腸桿菌發酵從質粒中產生 DNA 模板。使用限制性內切酶將質粒線性化并用于 IVT 反應,其中包含 NTP、緩沖液、MgCl2 以及 T7、SP6 或 T3 RNA 聚合酶,以在體外轉錄 mRNA。轉錄后修飾,包括 5' 加帽和 3' Poly (A) 尾添加,通常在 mRNA 合成后進行。使用 DNase 消化任何剩余的 DNA 模板。當前使用 CleanCap? 或帽類似物的加帽技術創新可以簡化反應過程,并在 IVT 反應期間完成 5' 加帽,同時添加由模板 DNA 編碼的 Poly(A) 尾。
IVT 反應后,必須從反應混合物中純化 mRNA,因為許多雜質包括酶、殘留的 NTP、殘留的 DNA 和來自提前中止反應的短 RNA,而雙鏈 RNA (dsRNA) 會刺激不需要的免疫反應并降低產品安全性。雖然目前還沒有基于法規要求的標準化純化方法,但目前各種mRNA抗原平臺采用多種純化和過濾方法。純化技術,例如尺寸排阻層析 (SEC)、離子對反相層析 (IPC)、離子交換層析 (IEC)、脫氧胸苷 (dT) – Oligo dT 親和層析、羥基磷灰石或疏水相互作用、多模式或基于纖維素的層析法。此外,切向流過濾 (TFF) 也可用于去除雜質,同時進行濃縮和溶液洗濾,使其成為大規模生產的通用過濾方法。 TFF 通常與 mRNA 沉淀結合使用,這樣可以保留 mRNA,同時通過洗濾去除雜質。常見的 IVT 純化方案通常結合使用 TFF,然后是層析步驟和第二個 TFF,以正確純化 mRNA,去除工藝污染物,并促進濃縮和緩沖液置換。
階段 2 和 3: RNA-LNP 的配制和終產品生產
mRNA產物制備完成后,進行LNP配制和包封,組裝疫苗抗原。這是通過使用微流控或基于噴射的快速混合技術,將在水性緩沖液中的 mRNA 和在乙醇中的脂質混合來實現的。然后使用 TFF 和除菌過濾純化載有 mRNA 的 LNP,用于第3階段的最終灌裝。在此階段,將除菌過濾和稀釋的 mRNA 疫苗添加到適當的小瓶中,加蓋并密封,以進行最終藥物產品包裝。
mRNA 疫苗質量源于設計 (QBD) 框架
要為 mRNA 疫苗設計有效的生產工藝,重要的是定義關鍵質量屬性 (CQA) 并了解生產高質量抗原所需的檢測類型。這種方法可以提供一個路線圖,根據有關當前生產疫苗的技術和監管要求的先驗知識來優化生產實踐,以調節 mRNA 抗原的質量,確保產品的效率、效力和安全性以及預期的免疫效果。
從 mRNA 疫苗活性物質到最終藥物產品,需要考慮各種 COA。例如,與 dsRNA 和 mRNA 結構元素(包括 5' 帽和 3' poly-(A) 尾)相關的質量屬性對于檢測和調節很重要,因為它們會影響細胞免疫反應、翻譯效率和轉錄本穩定性。同樣,對于 LNP 配制,了解顆粒大小、電荷和脂質含量對于優化藥物產品功效和細胞免疫反應至關重要。因此,生產框架的設計需要整合質量屬性和預期質量結果,以確定在整個生產過程中監控所需的 CQA。
mRNA 疫苗的生產工藝設計需要全面了解質量屬性和關鍵工藝參數之間的關系,以確保最終藥品的質量。首先要了解 mRNA 疫苗設計、可能影響疫苗質量的上游和下游工藝。例如,加帽機制等上游工藝可能需要額外的純化步驟,這可能會影響抗原產量。監測 IVT 反應時間和溫度有助于優化 mRNA 產量,同時保持轉錄本的質量。檢測這些參數對于確保 mRNA 疫苗抗原質量,以避免產品雜質(包括 dsRNA 顆粒污染物)非常重要。
下游工藝對于防止 mRNA 變性和沉淀很重要。例如,需要優化與 TFF 結合的商業規模層析方法的選擇,以確定 RNA 截留和純化的最佳條件,同時保持 mRNA 質量。此外,LNP 形成技術(包括混合率)會影響 mRNA 封裝和 LNP 顆粒完整性。目前,由于純化技術和表征工具之間缺乏明確的調節或優化方法來監測抗原產量,因此 mRNA 生產仍然存在許多未知的關鍵工藝參數。因此,有必要開發過程分析技術 (PAT) 解決方案,以更好地了解過程參數,確保最終產品的質量和純度。
用于 mRNA 生產的 PAT 和數字設計框架
為了連接關鍵質量屬性和過程控制,可以使用 PAT 開發分析工具。 PAT 使用數據模型創建工具,為工藝優化提供有關質量屬性的更多信息,并提供實時監控生物過程的解決方案,從而實現預測控制和過程自動化。目前,有許多離線技術被用于表征基于 mRNA 的疫苗的工藝參數,包括有關 mRNA 產量、回收率、總含量和結構完整性的信息。然而,有關 mRNA 序列、5' 帽、Poly(A) 尾長度和 RNA 純度的質量屬性仍需要額外檢測。此外,有關藥品純度的信息,包括來自大腸桿菌 DNA 模板生產的 dsRNA 污染物、殘留 DNA、酶和蛋白質,對于確保用于封裝的適當 mRNA 抗原溶液也很重要。最后,mRNA-LNP 顆粒的特征對于表征很重要,包括 RNA 封裝、LNP 大小、穩定性、電荷、形態、脂質含量和雜質,以確保疫苗將被有效和正確地包裝,以實現適當的細胞攝取。因此,質量源于設計 (QBD) 和 PAT 框架的目的和目標是設計能夠使用可適用于數字化建模和實時反饋的分析工具測量所有重要工藝參數和質量屬性的過程。
已經開發了各種 PAT 工具來在 mRNA 疫苗生產過程中實時測量 CQA。例如,可以集成 UV-VIS 光譜法或自動通量圓二色性 (CD) 來監測 RNA 完整性和雜質。紫外光譜可以應用到可用于測量 RNA 濃度的在線技術中。另一方面,CD 可用于測量 RNA 二級結構。在線動態光散射 (DLS) 可用于在下游純化過程步驟中測量 LNP 粒徑分布。包括核磁共振 (NMR) 在內的其它分析技術可用于實時監測,以識別脂質并量化脂質降解和其它特征,包括納米顆粒結構完整性。這些示例共同強調了開發 PAT 工具的必要性,這些工具可用于實時過程中監控 mRNA 關鍵質量屬性,以更好地理解和控制 mRNA 生產過程。
結論
對 mRNA 疫苗的需求不斷增加,需要標準化的方法和監管框架。它創造了對方法創新的需求,以更好地理解和測量 mRNA 疫苗產量、質量和安全概況所需的質量屬性。可以使用類似生產工藝調整 mRNA 抗原的多功能性,為開發可應用于未來 mRNA 疫苗抗原平臺數字生產的 QBD 框架和模型提供了極好的機會。本文中概述的分析工具的開發將有助于提高對上游和下游 mRNA 生產過程的了解。這提供了一個框架來幫助轉移工藝知識,這些知識可以針對新的疫苗抗原平臺進行調整和擴展。此外,PAT 工具的開發推進了工藝的數字化,并允許過程反饋控制,以優化 mRNA 疫苗生產流程。
原文:G.Gerzon, Y.Sheng, M.Kirkitadze, Landscape of mRNA vaccine design and manufacturing technologies. Biopharma-Asia, 2023.






