生物制藥行業使用許多復雜和創新的原材料,根據定義,這些原材料不屬于藥典。因此,這些原材料的控制由許可證持有人決定。直到最近,這種控制都是通過原材料供應商和零件ID的注冊來定義的。
甚至在COVID-19大流行之前,這一戰略就開始給供應鏈帶來壓力,因為它將采購限制在獨特的供應商和獨特的產品上。然而,在大流行期間和之后,如果制藥行業希望繼續向患者提供往往可以挽救生命的藥物,這一戰略已被證明不再有效。
糾正目前在工藝組件和材料供應方面的不靈活性是一個關鍵的行業優先事項,并與產品的注冊細節有關。
本文提出一種基于質量源于設計原則的、注冊創新和復雜原材料的最佳實踐方法。它可應用于生產生物制品時使用的非藥典原料的不同家族。
指引及規例
根據生產過程中原材料的使用地點和使用方式,多個指南涵蓋了對原材料描述的監管要求。例如,國際協調會議(ICH) Q6B(Specifications: test procedures and acceptance criteria for biotechnological/biological products)包含對原材料和賦形劑規范的要求。
ICH Q11(Development and manufacture of drug substances (chemical entities and biotechnological/ biological entities))描述了關于生物技術/生物原料藥來源和起始材料選擇的監管期望。它介紹了材料對照的定義,但在生物制品注冊方面遵循ICH Q5A(用于病毒安全性)、5B(用于細胞系)和5C(用于細胞底物)。
最后,ICH通用技術文件M4Q(質量)涵蓋了提交材料的最低要求。
這些文件設定了高水平的期望,其具體實施將有所不同。
注冊經驗
當審查如何在監管申報中描述材料時,有許多做法。
正如我們上面所看到的,這通常是通過材料的名稱和生物制藥產品的供應商來完成的,這意味著替代采購是復雜的。典型的策略是使用新材料重新驗證流程,然后通知或提交更改給不同的監管機構,以獲得批準。這可能需要數年時間才能在全球范圍內實現,從而造成供應鏈的延遲和中斷。
然而,當材料由其功能和關鍵材料屬性(CMA)定義時,策略變得更加靈活。根據ICH Q12(Technical and regulatory considerations for pharmaceutical product lifecycle management),這并不是因為需要較低的科學嚴謹性來證明更改的合理性,而是因為在實施之前不需要監管機構的事先批準。
等同的定義不隨提案而改變。替代材料將被期望滿足相同的預定標準,仍然可能需要多個批次,等等。本提案所提倡的唯一變化是,材料歸檔的方式允許滿足相同CMA定義的對產品質量、安全性和有效性具有相同影響的相同功能的材料之間的靈活性。
過程概述
CMA在“Understanding Pharmaceutical QbD”中定義為“輸入材料的物理、化學、生物或微生物性質或特征,應在適當的限度、范圍或分布內,以確保原料藥、賦形劑或過程中材料的所需質量”。
BioPhorum方法提供了一種基于QbD原則識別這些CMA的簡單而系統的過程,包括四個步驟:
定義目標材料概要文件(TMP)。
描述材料屬性。
審核產品匯總控制策略。
識別CMA以確保產品質量和安全。
然后遵循的原則是,原材料是通過其CAM在提交中注冊的,以允許:
通過對那些對產品質量至關重要的原材料屬性的明確理解,增加供應的靈活性,
提高監管提交的質量,以及
可能改善產品和工藝的穩健性。
該方法允許通過其CMA定義原材料,CMA可以注冊為與原材料和/或EC相關的控制策略的一部分。它的好處包括:
通過增強對產品和工藝的知識和理解,增加供應的靈活性
通過展示產品和工藝知識和理解來提高監管申報的質量
通過CMA的定義和控制改進產品和工藝過程的穩健性。
對于審查和批準生產授權的機構也有好處,例如:
提高監管提交的質量
如果批準后的變更可以記錄在生物制造商的PQS或產品年度報告中,則減少通知/補充的數量。
步驟描述
步驟1:TMP的定義
在這種方法中,我們將TMP定義為“在理想情況下將實現的材料特性的前瞻性總結,以確保所需的原料藥和/或藥品質量和安全,以及/或工藝性能。”換句話說,就是材料所扮演角色的描述。”
TMP建立在:
預期用途:定義該材料要發揮的作用。
質量標準:材料對產品質量和工藝性能的影響。
安全標準,例如可能傷害患者的潛在污染物的影響。
其它要求:通常需要確保實際的產品生產。
步驟2:材料屬性的描述
這涉及到理解材料特征的不同變量。這些可能包括化學屬性(如建筑材料)、物理屬性(如幾何形狀)、微生物屬性(如無菌)和其它安全屬性(如雜質)。
第三步:審查產品控制策略
在QbD提交中,產品和工藝知識和理解被總結在匯總控制策略中。
控制策略是該提議的先決條件,因為它描述了質量如何構建到生產過程中,以及放行測試如何是產品質量的驗證,而不是保險。它還描述了過程控制對下游工藝的影響,從而提出了產品質量的整體方法。
步驟4:定義確保產品質量和安全所需的CMA
TMP、材料屬性和匯總控制策略都有助于理解在特定工藝步驟中使用的材料中什么是重要的,以及什么可以被定義為原材料CMA。
通過對步驟2中確定的材料屬性、它們對TMP和/或產品控制策略的影響的系統審查來確定這些。影響評分描述如下:
低影響:基于產品和工藝知識和理解,該屬性對TMP或與材料及其使用相關的控制策略沒有貢獻。不需要更多的描述。
中等影響:基于產品和工藝知識和理解,該屬性可能有助于TMP或與材料及其使用相關的控制策略。該屬性與其它屬性結合時,對產品質量和工藝性能產生影響。中等影響的材料屬性可能需要控制。
高影響:基于產品和工藝知識和理解,該屬性直接有助于TMP或與材料及其使用相關的控制策略。
高影響屬性被定義為CMA。這些要求定義控制 (適當的限制、范圍或分布),以確保輸出材料的期望質量。CMA或極限、范圍或分布均不應改變以證明等效性。
中等影響屬性不定義為關鍵,但它們需要控制,因為當與其它更改結合時,它們可能會影響產品質量和過程性能。它們通常是預評估或驗證研究的一部分。
注冊策略
當上市許可持有人選擇使用這種方法來定義原材料時,圖1根據材料的使用地點和方式提供了關于通用技術文件(CTD)中所需信息的建議。
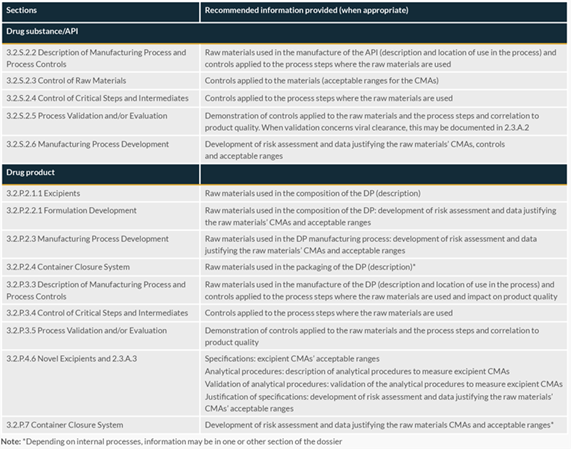
圖1:CTD中與原材料相關的信息位置
既定條件
ICH Q12將EC定義為確保產品質量所必需的、具有法律約束力的信息。因此,CMA被定義為原材料的EC。定義的EC的變化被認為是產品質量的潛在重大變化,因此需要事先獲得監管機構的批準。
報告的類別
根據ICH Q12,已批準EC的變更通過以下方式向監管機構報告:
提交適當的批準后監管文件,說明并論證對已批準EC的擬議修訂。論證可能包括驗證數據和批次分析等信息。
在原始上市許可申請中或作為批準后提交的一部分,提交批準后變更管理方案(PACMP),說明對EC或報告類別的修訂,以及如何對變更進行論證和報告。
酌情使用批準后的監管承諾。
這種事先批準的過程會導致時間延長和供應鏈中斷。但是,如果EC沒有改變(例如,兩種不同來源的材料實現了相同的CMA),則不需要事先批準,因為改變對產品質量沒有潛在的重大影響,從而允許快速實施和供應的靈活性。
該方法沒有為潛在的重大變更提供“免費通行證”,但允許許可持有人通過基于風險的方法關注對產品質量至關重要的領域。它還允許他們設計強大的可制造性研究,確定適當的控制,并主要在其藥品質量體系(PQS)中報告他們的工作。如有需要,變更將在產品年度報告或適度變更通知中報告,而不是在實施前需要監管機構審查和批準的批準后補充。
批準后變更管理方案
ICH Q12還將PACMP定義為一種工具,可將批準后的變更及其報告類別最小化。
作為一種證明對產品質量沒有影響的適當手段,PACMP被審查并與監管當局達成一致。這些方案和接受標準都是預先批準的。
因此,如果原材料沒有傳統的注冊(例如,通過其供應商和零件ID),這點就特別有用。或者,如果要改變EC,它們可以將變更類別從重大減少到適度,從而縮短審批時間,從而限制供應鏈的延遲和中斷。
結論
該提案旨在啟動生物制品行業原材料注冊的轉型變革。實施這些建議有望為產品控制策略(包括CMA)的注冊帶來不同的方法。






