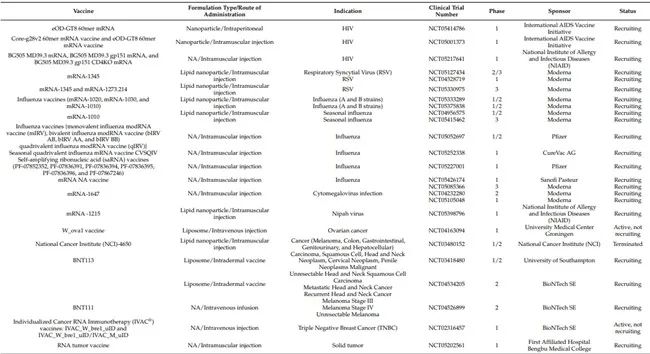
臨床前研究成功后和上市前的任何候選疫苗的關鍵步驟是臨床開發。任何 mRNA 疫苗的臨床開發都包括一系列臨床試驗,以評估人體的安全性、免疫原性和有效性。根據患者人群和試驗目標,它們被分為 1、2、3 和 4 期。1 期研究在一小群人(最好是一個中心)中進行,主要是為了確定該藥物的安全性和藥代動力學疫苗。2 期研究是概念驗證研究,主要旨在確認 1 期研究中獲得的結果,并評估在稍多人群中的療效。3 期研究是在多個中心和廣泛人群中進行的驗證性研究,以確認候選疫苗的有效性和安全性。這些研究通常使用活性比較劑或安慰劑進行。4期研究在候選疫苗獲批上市后進行,主要目的是確認疫苗的安全性。每種候選疫苗在商業上市前都應在所有臨床研究中進行關鍵的臨床評估。疫苗的開發需要幾年時間才能完成。然而,由于 COVID-19 大流行,Comirnaty(輝瑞)和 Spikevax(Moderna)在不到一年的時間內獲得了緊急使用授權(EUA)。目前,鑒于 mRNA 的能力,臨床試驗中有多種 mRNA 疫苗用于傳染病(COVID-19、流感、寨卡病毒、尼帕病毒、呼吸道合胞病毒等)、遺傳疾病和腫瘤適應性以及先天性免疫反應的疫苗。這些疫苗中的大多數都是基于脂質納米顆粒的,并且處于 1 期和 2 期臨床試驗階段。此外,正在進行的臨床研究中約有 60-70% 是使用基于 mRNA 的 COVID-19 疫苗平臺進行的。因此,我們在下表 1 中總結了所有正在進行的基于 mRNA 的疫苗(不包括 COVID-19 疫苗)的臨床試驗。如前所述,大多數 mRNA 疫苗處于臨床試驗的早期階段(1 或 2 期),只有少數基于 mRNA 的疫苗處于 3 期開發中。以下部分將提供有關目前處于 3 期臨床的疫苗的詳細信息。
表 1. 正在進行的 mRNA 疫苗臨床試驗(不包括 COVID-19 疫苗)。

mRNA-1345
mRNA-1345 是 Moderna 開發的、針對呼吸道合胞病毒 (RSV) 感染的候選疫苗,它編碼一種稱為融合前 F 糖蛋白的 RSV 蛋白,從而引發有效的中和抗體反應。這種蛋白質負責病毒的進入和細胞間的傳播,對 RSV 感染的傳播至關重要。該疫苗是一種基于脂質納米顆粒的疫苗,由優化的蛋白質和密碼子序列組成。美國 FDA 最近授予 mRNA-1345 快速審查資格,適用于 60 歲以上的成年人。由于免疫反應低下,在 mRNA-1345 之前為 RSV 感染開發的幾種疫苗在臨床試驗中失敗了。最近,Moderna 報告了正在進行的 1 期研究的中期結果,該研究評估了 mRNA-1345 在兒童、年輕人、老年人和育齡婦女中的耐受性、反應原性和免疫原性。結果顯示,截至數據截止日期,該疫苗在試驗的所有劑量水平下均具有良好的耐受性。該研究預計將于 2023 年完成。正在進行 mRNA-1345 疫苗 (NCT05127434) 在 ≥ 60 歲成人中的 2/3 期研究,以評估 mRNA-1345 疫苗的安全性和耐受性,并證明從注射后 14 天到 12 個月,與安慰劑相比,單劑 mRNA-1345 疫苗在預防 RSV 相關下呼吸道疾病 (RSV-LRTD) 首發方面的功效。該研究計劃分兩個安慰劑對照階段進行,即 400 至 2000 名參與者的 2 期研究和超過 30,000 名參與者的 3 期研究。該研究的主要目的是評估疫苗的安全性和有效性。安全終點包括監測參與者的不良反應、不良事件、嚴重不良事件以及特別關注不良事件的發生率。主要療效終點包括注射后 14 天至注射后 12 個月內 mRNA-1345 預防 RSV-LRTD 首次發作的疫苗效力(VE)。這項研究于 2021 年 11 月開始,預計將于 2024 年 11 月完成 (NCT05127434)。
mRNA-1010
mRNA-1010是Moderna開發的流感四價候選疫苗,根據世界衛生組織的推薦,編碼四種季節性流感病毒的表面蛋白、血凝素(HA)蛋白,包括季節性流感A/H1N1、A/ H3N2、流感 B/Yamagata 和 B/Victoria 譜系。HA 被認為是疫苗開發的重要目標,因為它可以產生針對流感的廣泛保護,并且是目前可用的流感疫苗的主要目標。mRNA-1010 的功效已在 1 期和 2 期研究中得到評估。2021 年 12 月,Moderna 發布了正在進行的I期研究的中期結果,該研究在年輕人和老年人中評估了 3 種劑量(50 μg、100 μg 和 200 μg)的 mRNA-1010。結果顯示,mRNA-1010 在所有參與者接種所有劑量疫苗后 29 天,成功地提高了針對所有毒株的血凝抑制測定的幾何平均滴度,沒有明顯的安全性問題發現。公司還證實,正在進行的 mRNA-1010 2 期研究已達到全部入組人數。正在進行 3 期主動對照研究(NCT05415462),以評估 ≥ 18 歲成年人接種mRNA-1010季節性流感疫苗后的體液免疫反應。活性比較劑是任何獲得許可的四價滅活季節性流感疫苗。本研究的主要目標是在第 29 天評估 mRNA-1010 相對于活性對照物對疫苗匹配的 A 型和 B 型流感病毒株的體液免疫原性,并評估 mRNA-1010 的安全性和反應原性。安全終點包括監測參與者的不良反應、不良事件、嚴重不良事件和特別關注不良事件的發生率。主要療效終點包括第 29 天抗血凝素 (HA) 抗體的幾何平均滴度 (GMT) 以及達到血清轉化的參與者百分比。這項研究于 2022 年 6 月開始,預計將于 2023 年 8 月完成 (NCT05415462)。
mRNA-1647
mRNA-1647 是 Moderna 開發的用于育齡婦女巨細胞病毒 (CMV) 感染的候選疫苗。它由六個 mRNA 組成,這些 mRNA 編碼 CMV 表面的兩種抗原。五個 mRNA 編碼形成膜結合五聚體復合物的亞基,而第六個編碼全長膜結合糖蛋白 B (gB)。mRNA-1647 疫苗指導人體細胞制造抗原,從而產生功能性抗原,模擬在自然感染期間由 CMV 呈遞給免疫系統的抗原。迄今為止,mRNA-1647 疫苗已在1期和2期研究中進行了評估。這兩項研究的中期分析結果是積極的,并推動了3期研究的開始,以確認 mRNA-1647 的有效性和安全性。這項 3 期研究 (NCT05085366) 是一項隨機、雙盲、安慰劑對照研究,旨在評估 mRNA-1647 疫苗在 16 至 40 歲的健康參與者中的功效、安全性和免疫原性。該研究的主要目的是評估 mRNA 1647 疫苗在 CMV 血清陰性女性參與者中的功效,并評估 mRNA-1647 疫苗在所有參與者中的安全性和反應原性。安全終點包括監測參與者的不良反應、不良事件、嚴重不良事件和特別關注不良事件的發生率。主要療效終點包括針對未由 mRNA-1647 編碼的抗原的血清免疫球蛋白 g (IgG) 從陰性結果到陽性的血清轉化(時間范圍:第 197 天(第三次注射后 28 天)至第 887 天(第三次注射后 24 個月)第三次注射))。該研究于 2021 年 10 月開始,預計將于 2025 年 7 月完成 (NCT05085366)。
mRNA疫苗的臨床安全性
任何候選疫苗臨床開發計劃中早期臨床試驗的主要目的是評估其在人群中的安全性。疫苗的安全性在整個臨床開發過程中通過主要監測不良事件、死亡、實驗室檢查結果等進行評估。任何疫苗的上市許可/批準只有在安全性可接受的情況下才有可能。如果在研究過程中發生任何不良事件,監管機構/機構倫理委員會可以停止臨床試驗,并且可以停止臨床開發計劃。預計與候選疫苗相關的不良事件應迅速得到解決/恢復。即使在疫苗獲得上市許可后,開發方仍有責任監控其安全性。由于核苷的存在,毒性是基于 mRNA 的疫苗需要考慮的重要因素之一。據文獻報道,一些核苷類抗癌藥和抗病毒藥的毒性是由于非天然核苷所致。具體到 mRNA 疫苗,肝毒性是在針對 Crigler-Najjar 綜合征開發疫苗的臨床前研究期間觀察到的最常見毒性。這可能是由于在用于遞送的脂質納米顆粒的配制過程中存在有毒賦形劑。在另一項針對狂犬病的 mRNA 疫苗的研究中,由于 mRNA 的炎癥性質,在臨床試驗中報告了全身性不良事件。與 mRNA 疫苗相關的大部分毒性主要是由于用于制劑的賦形劑或制劑開發過程中使用的其它溶劑。通過在其安全范圍內使用賦形劑并遵循減少疫苗中殘留有毒成分的流程,可以避免這些毒性。未來,基于 mRNA 的疫苗的預期毒性包括局部和全身炎癥、表達的免疫原的生物分布和持久性、自身反應性抗體的刺激,以及任何非天然核苷酸和遞送系統成分的潛在毒性作用。除上述之外,這些疫苗還可以誘導有效的 I 型干擾素反應、水腫(由于細胞外裸 RNA)、血液凝固和病理性血栓形成。另一方面,全球衛生當局已經批準了幾種 mRNA 疫苗供人類使用。所有批準的疫苗在臨床試驗評估期間都顯示出可接受的安全性。例如,來自 Pfizer–BioNTech (Comirnaty) 和 Moderna (Spikevax) 的兩種 COVID-19 mRNA 疫苗已證明具有出色的安全性和有效性。總的來說,臨床開發中幾種基于 mRNA 的疫苗的安全性是可以接受的(耐受性良好),迄今為止很少甚至沒有從臨床試驗中退出。臨床研究期間報告的大多數不良事件包括注射部位反應。通過在非臨床開發期間進行徹底的毒性測試,所有開發方都應將安全性視為疫苗開發過程中的一個重要因素。臨床試驗期間應考慮非臨床研究的觀察結果,并應仔細監測。






