小型設備可實現快速開發和優化,雖然有許多設備用于補料分批培養,但幾乎沒有可用于高細胞密度灌流培養的設備。為了彌補這一差距,在 mL 級微孔板中開發了偽灌流方法,能夠實現灌流培養的許多特定特征,包括高細胞密度、細胞截留以及提高生產力。在每天 1-2 次培養基置換之前,通過沉淀或離心 24 孔微孔板實現假灌流,產生高于 90% 的分離效率。培養基置換在第 3 天開始,達到每天 0.5-1.8 個罐體積 (VVD) 的灌流率。偽灌流方法實現最大活細胞密度 (VCD) 高達 42 × 10^6 cells/mL,比補料分批培養高 4.2 倍。體積生產率增加了 1.9 倍,產生了與工業水平相關的生產率。在沉降法和離心法之間觀察到類似的性能,當使用沉降法時,由于操作時間延長和分離前細胞密度降低而導致的微小偏差。微孔板 (MWP) 實驗在 5 L 規模下進行了驗證,并顯示出代謝物和生長曲線的可比性。這項工作展示了一種用于高通量開發研究的強大工具,該工具對培養基成分和置換率的變化很敏感,可以可靠地用于高細胞密度灌流培養的初步篩選。
簡介
隨著單克隆抗體 (mAb) 等治療性蛋白質的生產規模越來越大,行業正在轉向連續工藝,以提高效率。灌流培養方法的實施提供了更高的生產率、更小的設施占地面積和更低的商品成本,但該技術的廣泛采用受到批次失敗的高風險和設置的復雜性的阻礙。與補料分批相比,最近的技術進步降低了失敗率,提高了灌流培養的生產率并減少了批次間的可變性。此外,長期穩態灌流培養操作可確保產品質量始終如一,這促使監管機構提出了推動實施連續生物生產的舉措。
有人提出,灌流培養方法的成功取決于降低灌流速率的能力,理想情況下降至每天 1 個罐體積 (VVD) 以下。這確保了使用最少的液體吞吐量實現高滴度,從而降低了運營成本。為了降低灌流速率,必須仔細選擇細胞系,并優化培養基,以確保適當的營養深度和滲透壓。使用高通量 mL 規模設備提供了選擇性能最佳的細胞系并通過并行運行實驗進行培養基研究的可能性,從而減少了與早期開發相關的時間尺度和成本。雖然微孔板和微型生物反應器等設備已廣泛用于補料分批培養,但灌流培養的等效平臺仍在開發中。由于灌流操作需要優化多個過程參數,因此在 L 級規模臺式生物反應器中執行時,這可能是資源密集型和低通量的。作為替代方案,通常使用搖瓶、搖管或微孔板中的偽灌流。
這些偽灌流系統的幾個例子之前已經被描述過,將“離散”的培養基置換和細胞截留整合到用于 CHO 細胞培養的預先存在的補料分批工藝中。示例包括搖瓶、離心管和mL級生物反應器。偽灌流搖瓶已達到 70 × 10^6 cells/mL 的細胞密度。然而,搖瓶是勞動密集型的,并且它們的操作難以自動化,而自動化在篩選 100 種條件時是非常可取的策略。搖管的工作體積通常在 10 到 50 mL 之間,并以 220 到 320 rpm 之間的速度 N 搖動。細胞分離是通過在培養基交換之前離心來實現的,在工作體積的 40% 和 100% 之間變化。Villiger-Oberbek 等人報告活細胞密度高達 50 × 10^6 cells/mL,而 Karst 等人維持 15 × 10^6 cells/mL 的穩定相培養以進行動態代謝分析。已報道使用 ambr15? 模擬灌流培養,利用沉淀作為細胞截留機制或采用恒化器模式。沉降方法需要 40-60 分鐘的時間,以允許細胞沉降,其中包括在去除上清液和每天最多 8 次在培養基添加之前臨時關閉 pH、DO 和攪拌器控制。然而,在沉淀過程中長時間關閉控制可能會導致 pH 值和 DO 峰值,隨著培養的進行,對細胞健康有害。恒化器模式包括脈沖培養基添加,無需任何細胞截留步驟,同時保持恒定體積。據報道,活細胞密度高達 20 × 10^5 cells/mL,雖然周期性培養基置換可以被認為是模擬灌流方法中大量培養基置換的基礎,但這種方法受限于沒有細胞截留步驟。此外,ambr250? 可用于模擬灌流培養,但這可能涉及大量購買和運營成本。到目前為止提出的所有方法的工作體積都在 10 到 250 mL 之間,但是,為了進行初步篩選和優化研究,工作體積更低的平臺將允許以更低的成本進行高通量實驗。
微孔板經常用于批次和補料分批細胞培養的高通量開發研究。與搖瓶、搖管和微型生物反應器相比,其有可能顯著降低運營成本,并大大提高實驗通量。使用板蓋可最大限度地減少蒸發,同時最大限度地提高氧轉移率,這意味著微孔培養能夠在無菌環境中長時間維持。微孔板依賴于頂空氧氣轉移,振蕩速度和表面積與體積比被確定為最大化氧氣轉移的重要影響因素,即影響氣液傳質系數 kLa。雖然 kLa 隨著振蕩頻率的增加而增加,但可能會達到臨界振蕩速度,在該速度下可能會觀察到對細胞培養的不利影響。據報道,5-55 hr-1 的 kLa 支持高達 10^8 cells/mL,據報道,24 孔板的 kLa 為 12 hr-1,填充體積為 1 mL,以 225 rpm 的速度搖動并覆蓋具有透氣膜。因此,已公布的微孔板 kLa 值表明氧氣不會成為細胞密度高于 10^7 時 CHO 細胞生長的限制因素。
Huang等在工作體積為 3 mL 的 24 孔板中開發了一種方法,其中細胞以目標細胞密度接種,介于 20 和 30 × 10^6 cells/mL 之間。在他們的工作中,使用 100% 的工作體積通過每日離心和培養基置換來維持恒定的細胞密度。穩定培養的研究表明是代謝分析的有用工具,但是穩定相的分析僅限制了選擇性能最佳的細胞克隆和培養基的能力。在這項工作中,描述了微孔板中偽灌流方法的開發,該方法能夠實現生物反應器灌流培養的特征,即細胞截留能力、高細胞密度和提高的生產力。兩種關鍵的細胞截留方法,沉淀和離心,已經以微孔板形式開發并與培養步驟相結合,以允許對每種方法作為競爭性選項進行比較和嚴格評估。
詳細的試驗方法、結果與討論,請參考原文。
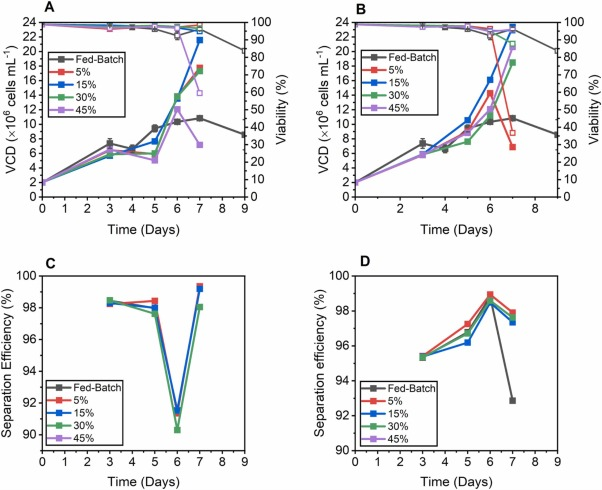
圖 1. 補料分批、沉降和離心培養的性能比較,使用添加有 5%、15%、30% 和 45% EfficientFeed? B v/v 的培養基進行置換。在 1 VVD 條件下,補料分批培養和沉淀培養 的(A) VCD(實心方塊)和活性趨勢(空心方塊)。(B) 補料分批培養和離心培養的 VCD(實心方塊)和活性(空心方塊)。(C) 沉淀培養的分離效率。(D) 離心培養物的分離效率。
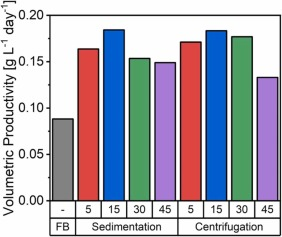
圖 2. 補料分批培養和沉降以及離心偽灌流培養的單位體積生產率比較,使用添加有 5%、15%、30% 或 45% EfficientFeed? B 的培養基進行置換。
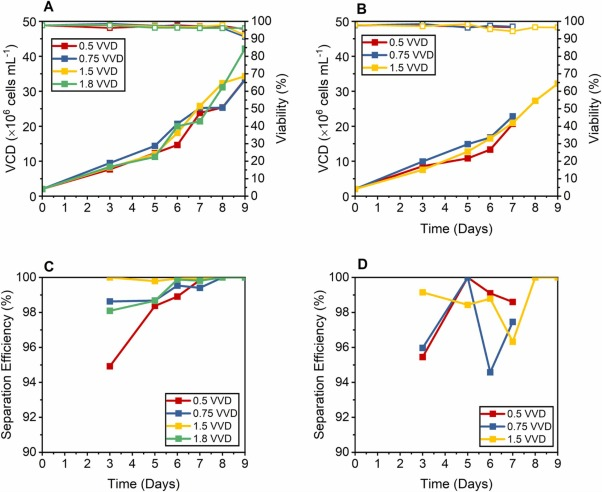
圖 3. 沉降和離心培養物的性能比較,使用添加有 15% EfficientFeed? B v/v 的培養基,分別以 0.5、0.75、1.5 和 1.8 VVD 進行置換,(A) 沉淀培養的VCD(實心方塊)和活性趨勢, (B) 離心培養的 VCD(實心方塊)和活性趨勢(空心方塊)。(C) 沉淀培養的分離效率。(D) 離心培養的分離效率。1.8 VVD 未進行沉降測試,因為每天兩次的最大交換體積為 75%。
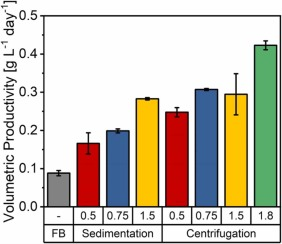
圖 4. 沉淀和離心偽灌流培養的單位體積生產率比較,使用添加了 15% EfficientFeed? B 的培養基進行置換,置換率為 0.5、0.75、1.5 和 1.8 VVD。這些值代表培養期間單位體積生產率的平均值。由于每天兩次的最大置換體積為 75%,因此未對 1.8 VVD 的灌流速率進行沉降測試。
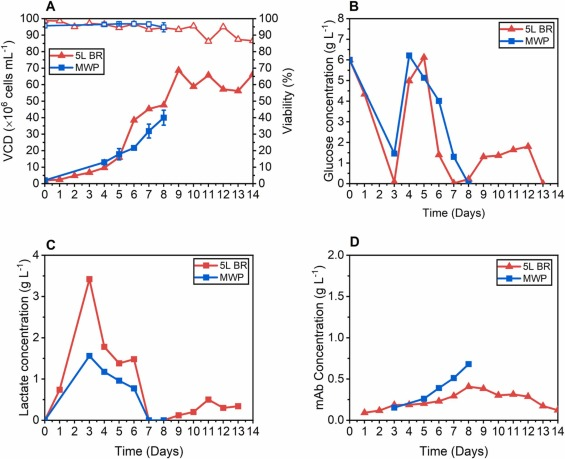
圖 5. MWP 偽灌流方法與 5 L 灌流生物反應器的比較 (A) VCD 生長曲線(實心方塊)和相關細胞活性(空心方塊)(B) 葡萄糖濃度 (C) 乳酸濃度和 (D) mAb濃度。
總結
與補料分批培養相比,在微孔板中開發了一種偽灌流方法,該方法結合了細胞截留能力并產生更高的細胞密度和單位體積生產率。沉淀和離心方法具有相似的培養性能,但由于在沉淀培養中分離之前更長的操作時間和較低的累積細胞密度而存在微小偏差。偽灌流方法被證明對培養基成分的變化很敏感,這使得該系統有望用于灌流培養的早期開發。在分析的所有條件下,使用偽灌流方法延長至第 9 天的培養中達到的最高 VCD 比補料分批操作高 3.3-4.2 倍。1.5 和 1.8 VVD 的更高灌流速率以及更高的 CSPR,在 0.05 和 0.06 nL/cell/day 之間,產生的單位體積生產率比補料分批高 1.9 倍,并且提高微孔板中的偽灌流方法能夠模仿灌流培養的許多具體特征,與之前報道的偽灌流技術相比,體積減少了 8 倍。一組選定的工藝參數(即 1VVD)被轉移到 5L 灌流生物反應器中,顯示出可比較的細胞生長和生產力結果。微孔板中的偽灌流方法是用于灌流培養早期開發和篩選的強大、高通量工具。將該系統集成到自動液體處理設備中可以進一步擴展功能,提高可靠性和一致性。
原文:M. Tregidgo, C. Lucas, M. Dorn, et al., Development of mL-scale pseudo-perfusion methodologies for high-throughput early phase development studies. Biochemical Engineering Journal, 2023.






