流行病防范創(chuàng)新聯(lián)盟(Coalition for Epidemic Preparedness Innovations, CEPI)提出了一個“100天任務(wù)”,或“登月”計劃,將從病原體鑒定到推出新疫苗的時間壓縮到100天。與此同時,還認識到第二個100天的重要性,即大規(guī)模推出一種新疫苗。具有已知安全性、免疫原性、生產(chǎn)和分發(fā)特征的疫苗平臺技術(shù)對于應(yīng)對這些挑戰(zhàn)至關(guān)重要。
新疫苗的臨床前和臨床開發(fā)的許多特點是獨立于平臺技術(shù)的。在基于不同平臺部署疫苗的途徑中,生產(chǎn)和分發(fā)是主要的分歧點。在這里,我們表明,腺病毒載體疫苗的“快速響應(yīng)”生產(chǎn)可以縮短開發(fā)時間表,與其它平臺競爭,在此,我們將討論改進疫苗生產(chǎn)對未來疫情應(yīng)對和公平獲得疫苗的影響。
腺病毒載體提供了一個快速適應(yīng)和可部署的平臺,具有經(jīng)過驗證的安全性和有效性,在實現(xiàn)公平獲取方面具有特別優(yōu)勢。牛津大學(xué)和阿斯利康基于黑猩猩腺病毒平臺開發(fā)的Vaxzevria (ChAdOx1 nCoV-19) COVID-19疫苗估計在2021年挽救了約600萬人的生命。對79項實際有效性研究的回顧證實了其對死亡或嚴重疾病的高療效。伴血小板減少綜合征的血栓形成在腺病毒載體疫苗接種者中很少發(fā)生,在歐洲和北美以外的數(shù)據(jù)集中更為罕見。在許多情況下 - 包括對高死亡率病原體的應(yīng)急反應(yīng)和沒有現(xiàn)有疫苗的情況下 - 這種綜合征的發(fā)生頻率對疫苗接種的風險/效益平衡影響不大。
我們與阿斯利康和其它工業(yè)合作伙伴一起開發(fā)了一種簡單的生產(chǎn)工藝,在五大洲12個國家的設(shè)施網(wǎng)絡(luò)中生產(chǎn)了30多億劑。生產(chǎn)成本低,而且疫苗適合冷藏而不是冷凍儲存,因此能夠向難以獲得服務(wù)的社區(qū),特別是中低收入國家,分發(fā)疫苗。
然而,除了這些積極的特征外,腺病毒生產(chǎn)也有兩個明顯的缺點。首先,準備病毒種子作為生產(chǎn)的起始材料所花費的時間延遲了臨床試驗的首批可用性。2020年,在病原體序列發(fā)表63天后,首次在人體中使用了mRNA SARS-CoV-2疫苗。第一批ChAdOx1 nCoV-19臨床批次直到一個月后才放行。其次,mRNA疫苗的單位體積生產(chǎn)力 (每升生物反應(yīng)器容量的劑量數(shù)) 估計至少比ChAdOx1 nCoV-19疫苗每升大約2000劑的數(shù)值高一個數(shù)量級。這就需要更大的“占地”來生產(chǎn)腺病毒載體原料藥 (疫苗原液)。
我們最近發(fā)表了一篇文章,試圖解決這些問題。我們表明,簡化病毒種子生產(chǎn)可以在新病原體序列可用的60天內(nèi)放行第一批用于臨床試驗的疫苗批次,并在100天內(nèi)放行第一批大規(guī)模商業(yè)批次 (圖1a)。我們還發(fā)現(xiàn),與商業(yè)化生產(chǎn)ChAdOx1 nCoV-19的工藝相比,強化上游工藝 (即細胞培養(yǎng)和病毒復(fù)制) 可以使單位體積生產(chǎn)力提高四倍。改進后的工藝每升生物反應(yīng)器培養(yǎng)產(chǎn)生約8 × 10^14純化原料藥病毒顆粒(VP),足以生產(chǎn)>10,000劑藥品。
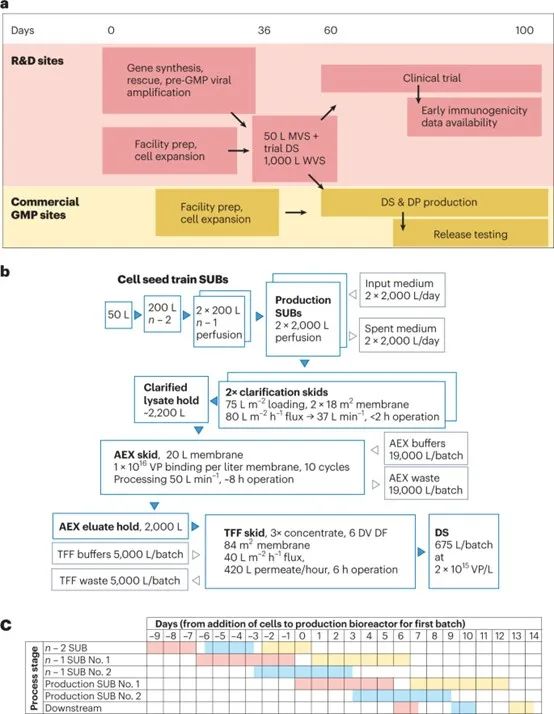
圖1:加速高產(chǎn)量腺病毒生產(chǎn)。a.開發(fā)活動的高水平概述,包括種子生產(chǎn)、臨床試驗疫苗供應(yīng)、臨床試驗執(zhí)行和大規(guī)模生產(chǎn),從而能夠在第100天放行第一批商業(yè)規(guī)模的批次。b、設(shè)備、產(chǎn)品和物料在模擬設(shè)施中的流動。c、生產(chǎn)計劃說明,顯示使用兩個n - 1反應(yīng)器,兩個生產(chǎn)生物反應(yīng)器和一個下游純化鏈。粉色、藍色和黃色分別表示第一批、第二批和第三批。
我們現(xiàn)在描述這種改進的生產(chǎn)工藝的商業(yè)規(guī)模實施的技術(shù)經(jīng)濟模型 (圖1b)。使用Biosolve Process 8軟件(Biopharm Services) 構(gòu)建和評估模型。我們模擬了一個設(shè)施,該設(shè)施使用一個200 L的“n- 2”生物反應(yīng)器,用于交替接種兩個200 L灌注 “n- 1”生物反應(yīng)器,依次為兩個2000 L生產(chǎn)生物反應(yīng)器和一個下游純化裝置提供服務(wù)。以下假設(shè)基于我們發(fā)表的數(shù)據(jù):細胞倍增時間36 h;上游工藝生產(chǎn)率1.5 × 10^12 VP/mL;收獲時benzonase核酸酶濃度100 units/mL;澄清過濾器上樣可達1 × 10^12 cells/m2,對應(yīng)75 L/m2,峰值細胞密度1 × 10^7 cells/mL,安全系數(shù)為33%;澄清產(chǎn)物回收率66%;陰離子交換膜結(jié)合容量1 × 10^16 VP/L;陰離子交換回收率90%;切向流過濾過濾器上樣2 × 10^16 VP/m2。切向流過濾階段的濃度限制在生物反應(yīng)器體積的0.33倍,對應(yīng)于2.2 × 10^12 VP/mL的預(yù)期產(chǎn)物濃度。成本基于賽多利斯和Biosolve的專有數(shù)據(jù)庫。
這種生物反應(yīng)器配置可以每3.5天提供一批 (圖1c)。與缺乏種子灌流擴增和使用一次性生產(chǎn)生物反應(yīng)器的設(shè)施相比,這一設(shè)施的產(chǎn)量增加了一倍以上。在n - 1條件下使用灌流使細胞擴增更多,減少了生產(chǎn)生物反應(yīng)器的周期時間。一個純化鏈仍然足以處理兩個生產(chǎn)反應(yīng)器的輸出。下游工藝可以通過對用于全球生產(chǎn)ChAdOx1 nCoV-19的設(shè)備進行適度修改來執(zhí)行。雖然與其它工藝階段相比,AEX所需的緩沖液體積很大,但對于許多設(shè)施來說,通過使用緩沖濃縮液和在線稀釋技術(shù),這些緩沖液可能是可控的。到目前為止,我們還沒有優(yōu)化最終的切向流過濾,以最小化所需的膜面積,我們的模型基于我們未優(yōu)化的經(jīng)驗,使用了謹慎的假設(shè)。預(yù)計每批切向流過濾膜面積為84 m2,這突出了這種優(yōu)化的必要性,但仍然可以使用定制的切向流過濾系統(tǒng)或在現(xiàn)成的系統(tǒng)上進行多次循環(huán)來實現(xiàn)。
假設(shè)設(shè)施使用率為70%,預(yù)計單個這樣的設(shè)施每年可生產(chǎn)約13億劑,原料藥成本低于每劑0.11美元 (低于用于生產(chǎn)ChAdOx1 nCoV-19的補料分批工藝)。這相當于每天每升生物反應(yīng)器容量大約輸出900劑。建造和裝備這一設(shè)施的資本支出約為4300萬美元,每年的業(yè)務(wù)支出不到1.1億美元。
在應(yīng)急響應(yīng)的短期最大產(chǎn)能運行的替代假設(shè)下,我們估計8個這樣的設(shè)施(即已安裝的生物反應(yīng)器總產(chǎn)能為32,000 L)每月可提供總共10億劑。雖然規(guī)模很大,但這將小于2021年生產(chǎn)ChAdOx1 nCoV-19的設(shè)施網(wǎng)絡(luò)。我們認為,一些現(xiàn)有設(shè)施 (包括一些低收入和中等收入國家的設(shè)施) 將是合適的。
這些結(jié)果對防范未來的大流行具有若干意義。
在我們改進腺病毒生產(chǎn)平臺的工作中,我們最初專注于三個基于時間的指標:從病原體序列可用性到放行第一批臨床試驗批次、第一批商業(yè)批次和第10億劑的時間。與2020年的情況相比,我們認為腺病毒生產(chǎn)和其它平臺技術(shù)現(xiàn)在都有能力滿足CEPI“100天”的目標。在比這短得多的時間內(nèi)完成臨床前和臨床開發(fā)似乎不太可能。在第二個一百天內(nèi),我們的模型表明,一個準備充分的全球努力,使用一個實際規(guī)模的生產(chǎn)網(wǎng)絡(luò),可以放行超過30億劑。這足以為全球很大一部分人口提供第一劑疫苗,其產(chǎn)出水平是任何COVID-19疫苗規(guī)劃都需要兩年多才能達到的。
在2020年至2022年期間,技術(shù)上可行的疫苗生產(chǎn)速度發(fā)生了階段性變化。現(xiàn)在,實現(xiàn)這樣的生產(chǎn)速度已經(jīng)不是技術(shù)可行性的問題,主要是資金和準備的問題,包括降低失敗風險和提前準備監(jiān)管文件模板。在我們看來,我們所描述的工藝的一個完全驗證的版本,最好包括一個獨立的并行種子生產(chǎn)“備份活動”,并由快速周轉(zhuǎn)平臺分析支持,將提供更高的成功“信心”。
質(zhì)量控制測試限制了疫苗的可獲得性。我們建議的時間表 (圖1a) 允許第一批臨床試驗批次的放行測試16天,第一批商業(yè)批次的測試35天。這一差異是由于對商業(yè)物料采用28天體外培養(yǎng)法檢測外源性病毒物質(zhì)和具有復(fù)制能力的腺病毒,而對臨床試驗材料采用基于核酸的檢測 (支持14天體外檢測)。充分驗證PCR或下一代基于測序的污染物檢測方法,可以將第一批商業(yè)批次的放行提前到第80天或更早。
進一步的改進是可能的。然而,從生產(chǎn)的角度來看,任何疫苗平臺都可能具有競爭力,因為它能夠在100天內(nèi)實現(xiàn)第一批商業(yè)批次,每天每升生物反應(yīng)器容量生產(chǎn)1,000劑,并且每劑原料藥的成本< 1美元。進一步的改進可能提供相對較小的效益。領(lǐng)先的疫苗平臺現(xiàn)在已經(jīng)達到了所需的生產(chǎn)速度和設(shè)施生產(chǎn)力的水平,在這種水平上,其它因素可能更為重要。這些考慮因素包括安全性、耐受性、有效性、穩(wěn)定性、成本、方案適用性、個體接受者偏好以及生產(chǎn)商支持技術(shù)轉(zhuǎn)移的意愿。在不同情況下選擇不同的疫苗可能有合理的科學(xué)理由。
未來的流行病是不可避免的。及時獲得多種疫苗 (包括腺病毒) 對于保護公眾健康是必要的。我們認為,維持一個區(qū)域性設(shè)施網(wǎng)絡(luò) “預(yù)熱” (預(yù)先配備人員、預(yù)先儲備物料和預(yù)先融資),以生產(chǎn)任何十億劑規(guī)模的腺病毒載體疫苗,作為一種全球公共產(chǎn)品,在經(jīng)濟上是有吸引力的。在我們的模型的基礎(chǔ)上,每年可能需要花費不到2.2億美元來資助一個全球設(shè)施網(wǎng)絡(luò),該網(wǎng)絡(luò)能夠在發(fā)現(xiàn)一種新的病原體后的200天內(nèi)向許多國家提供10億劑腺病毒載體疫苗。這一估計是基于擁有足夠的物料和耗材庫存,以生產(chǎn)10億劑 (55批,每批提供約1800萬劑,物料和耗材每批約130萬美元),并每12個月更新一次庫存。一些物料和耗材的保質(zhì)期將超過12個月,降低成本,但不包括倉儲成本。快速響應(yīng)需要利用已有的設(shè)施 - 例如,在兩次流行病之間生產(chǎn)其它疫苗或生物制品的合同生產(chǎn)組織的設(shè)施 - 并就發(fā)生大流行時的緊急"隨叫隨到"權(quán)利合同進行談判。利用現(xiàn)有設(shè)施將降低資本投入和勞動力成本,盡管預(yù)計這些成本只占疫苗生產(chǎn)總成本的一小部分。一個關(guān)鍵的不確定因素是設(shè)施緊急可用性的費用。在兩次大流行之間,這將需要維持對工作人員的培訓(xùn)和工藝驗證,可能需要間歇地執(zhí)行該工藝,而且 - 至關(guān)重要的是 - 將防止使用該設(shè)施生產(chǎn)不允許中斷數(shù)月的產(chǎn)品。我們的估計是假設(shè)每個設(shè)施每年可以以大約1100萬至1600萬美元的價格獲得這種可隨時進入的能力,這在五年的時間里接近一個專門建造的設(shè)施的總資本和勞動力成本。采用類似工藝生產(chǎn)另一種用于非大流行適應(yīng)癥的病毒載體的設(shè)施,或?qū)藗€生產(chǎn)鏈集中在較少數(shù)量的設(shè)施中,可能會獲得更高的成本效益。
建立這種“預(yù)熱”網(wǎng)絡(luò)的成本很高,但僅相當于COVID-19大流行12.5萬億美元全球成本的0.002% (據(jù)國際貨幣基金組織估計),或2021年全球COVID-19疫苗支出的0.4%左右。哪個實體可能資助和委托這樣一個腺病毒網(wǎng)絡(luò)或任何其它疫苗平臺,這對全球決策者來說是一個懸而未決的問題,因為這超出了CEPI支持研究和開發(fā)的核心角色。
原文:C.C.D.Joe, N.Chopra, P.Nestola, et al., Rapid-response manufacturing of adenovirus-vectored vaccines. Nature Biotechnology, 2023.






