對工藝性能和產品質量有重大影響的關鍵原材料的準確指紋識別是在工藝和產品開發中實施 QbD 的必要先決條件。本文回顧了過去 10 年這一領域的主要發展,特別強調了過去 5 年的發展。研究已經提出了在 QbD 范例中管理原材料的逐步方法。我們認為,如果要全面實施 QbD,生物技術行業有必要更好地管理源自原材料的可變性。
簡介
生物制藥生產,由于其復雜的非線性性質,充滿了無數的工藝變化,這些變化可能會影響藥物的安全性和有效性。自從二十多年前引入工藝表征和實驗設計 (DoE) 等概念以來,生物制藥行業在揭示工藝如何影響產品方面已經創造并展示了相當多的專業知識。然而,原材料 (RM) 的作用在某種程度上被忽視了,因此已成為工藝性能和產品質量可變性的主要來源。從ICH Q8指南中可以明顯看出,原材料在過程控制策略中的作用越來越重要,該指南建議在“質量源于設計”(QbD)框架中,制造商必須了解包括原材料在內的所有可變性來源。
生物制藥生產中使用的原材料來源多種多樣,包括用于細胞培養和發酵的培養基成分,用于純化和化學修飾過程的精細化學品,以及用于最終藥品制劑的賦形劑。它們還包括產品接觸材料,如一次性塑料袋中使用的塑料。原材料的可變性可能來自于材料的化學或物理特性的變化。這種可變性會影響藥品的特性和質量,并可能影響藥品的安全性、穩定性和有效性。有時,這會導致嚴重的不良事件,甚至導致藥物召回。例如,在過去幾年中,藥品中玻璃顆粒的存在導致了20多個產品的召回,包括Procrit和Epogen注射劑的召回。
原材料可變性的類型
原材料的可變性可以細分為三大類。第一類包括通過直接修飾或通過催化修飾 (如過氧化物、醛、還原糖和催化活性金屬離子) 改變生物治療藥物質量的微量雜質。第二類由微量雜質組成,這些雜質本身對人體有毒,如鉛和鋁。第三類包括微生物污染物 (及其相關的內毒素),它們導致原材料的生物負荷發生變化,并可能導致患者產生嚴重的免疫反應。每一個都需要它們自己的監視和控制方法。
可變性的來源
用于生產重組蛋白的細胞培養工藝使用復雜的生長培養基。雖然一些細胞可以在基礎培養基中生產而不需要添加物,但大多數細胞需要添加多達100種成分,如激素、生長因子、維生素、肽、氨基酸和水解物來生長。自然源性的培養基可含有大量化合物。它們還含有微量營養素。
由于幾個原因,可變性可能在培養基中蔓延。培養基中存在的原料、雜質和污染物的降解;大批量生產中,由于微量營養素的損失,導致研磨和混合不均勻;由于可用性的限制,含量水平的不一致和原材料采購的變化會導致原材料的可變性。雖然在過去的十年中已經轉向使用化學限定的培養基,但天然培養基繼續被行業使用,并繼續為保持一致的產品質量提供挑戰。即使是化學限定的培養基也有復雜的組成,這就需要對其進行表征、以達到一致的工藝性能。
賦形劑質量不一致會對藥品質量產生不良影響。賦形劑源性的污染物可分為以下幾類:微量金屬、過氧化物、醛類、還原糖/多元醇和有機酸。這些賦形劑的純度水平可能會有很大差異,并在不同程度上影響產品的質量/穩定性。即使是純賦形劑,在儲存過程中也可能通過各種降解途徑而產生污染物。例如,聚山梨酸酯會發生自氧化,從而影響生物制藥產品的穩定性。容器/封閉系統的析出物已被證明對產品質量有重大影響,最近的一些問題證明了這一點:玻璃小瓶中的玻璃薄片、預填充注射器中的鎢、小瓶塞或預填充注射器桶中的硅、過濾器中的析出物以及灌裝泵溶液接觸表面的納米顆粒脫落。層析填料的批次間差異也可能導致產量或產品質量的意外變化。
基于QbD的原材料管理方法
國際協調會議 (ICH) 在其Q7良好生產規范、Q8藥物開發、Q9質量風險評估和Q10藥品質量體系指南中對產品質量提出了嚴格的要求。現行的原料分析方法在ICH Q7指南中有描述。該文件指出,用于制備活性藥物成分 (小分子和生物制劑) 的材料需要在收到時確認每個批次的標識,并提供供應商提供的分析證書 (CoA)。藥典和處方專著,如USP/NF、EuP、JP和BP,為最常見和廣泛使用的材料提供了標準化的測試方法。制造商采用各種方法來測試原材料的合規性。一些公司通過對原材料供應商進行初步詳細的供應商審核,然后根據藥典各論對三批原材料進行年度鑒定,從而對原材料供應商進行質量確認。如果合格批次測試成功,那么隨后的材料出貨將只需要各論鑒定測試。然而,對原材料放行采取更為保守的方法的公司要求對每批供應的材料進行全面的專著測試。此外,根據對供應商設施的審核,供應商必須是合格的,其分析結果必須是可靠的,并且每種來料都需要一個抽樣計劃。
關鍵/重要原材料 |
↓ |
了解其對工藝和產品的“影響” |
↓ |
識別原材料的關鍵屬性 |
↓ |
創建關鍵屬性特征的分析方法 |
↓ |
收集數據對原材料進行指紋識別 |
↓ |
實施方法以識別可接受和不可接受的原材料批次 |
圖1. 在QbD范式中管理原材料
一個關鍵的挑戰是用于生物制藥生產的相對較大的原材料數量 (通常> 100)。為了有效地處理如此大量的原材料,已經提出了一種基于QbD的多步驟方法 (圖1)。建議在產品開發的每個主要里程碑 (動物試驗、I期、II期、III期和驗證) 進行這種評估。雖然第一次執行時是一項艱巨的任務,但由于大多數原材料在同類產品 (例如單克隆抗體) 中是相同的,因此在接下來的時間內工作量大大減少:
對工藝中使用的所有原材料進行風險評估。有許多不同的風險評估工具,其細節和復雜性各不相同,重要的是要使用適合評估目的的方法。適當的涉眾,如工藝開發、生產、質量保證和質量控制,都包括在這個評估中。團隊討論原材料是否有可能影響工藝性能,是否有可能影響產品質量。那些可能影響兩者的被稱為關鍵原材料,那些只影響工藝過程而不影響產品的被稱為重要原材料,那些預計不會影響任何一方的被稱為非關鍵原材料。
然后,關鍵原材料被徹底表征,其與過程相互作用的機制被很好地理解。制造商應該了解原材料是如何影響生產過程和產品的。需要識別可用于表征這種影響的原材料屬性,并建立這些屬性的可接受標準。需要開發分析測試來監控這些屬性,以確保每個關鍵原材料批次在使用前符合各自的驗收標準。
重要原材料的表征可以與關鍵原材料相同,但關鍵原材料對每個產品都要進行這種分析,而重要原材料需要對一個平臺進行一次表征分析。每次將新的重要原材料添加到平臺上,在使用前都會對其進行徹底的表征。
非關鍵原材料包括剩余 (和大部分) 原料,并通過生物制藥制造商的內部質量體系進行處理,就像傳統制藥一樣。
評估可變性的工具
基于原材料如何影響工藝過程和產品質量的詳細表征的原材料指紋為上述難題提供了一個潛在的解決方案。便于對原料質量進行高效且有效的監控,防止對產品質量產生重大不利影響。
分析工具
對原材料的評估涉及到使用廣泛的分析技術,如光譜、色譜和基于酶的工具。光譜技術是快速的,并已被證明可以相當有效的監測原材料質量中的變化,因此是首選的工具。拉曼光譜、近紅外光譜(NIR)、傅里葉變換紅外光譜(FTIR)、中紅外光譜(MIR)、熒光光譜和核磁共振 (NMR) 已被用于原材料的鑒定和表征。研究人員最近評估了幾種光譜技術用于檢測生物制藥制劑中常用的兩種賦形劑 - 三甲胺(Tris) 和鹽酸三甲胺(Tris- HCL) 的摻假的能力和適用性。對近紅外(NIR)、拉曼(手持式拉曼和拉曼顯微鏡)、傅里葉變換紅外(FTIR)和核磁共振(NMR)進行了評估,并在分析速度和區分摻假和未摻假樣品的能力方面強調了它們的優缺點。在其它研究中,質譜 (MS) 已被證明具有顯著的高靈敏度,但用于常規原材料的放行檢測是昂貴的,而且執行起來也很麻煩。金納米顆粒表面增強拉曼光譜 (SERS) 已成功用于檢測蛋白質制藥原料中的微量三聚氰胺。最近的一篇綜述提供了一份廣泛的工具清單,其用于生物制藥生產中細胞培養基的可變性來源檢測,以及它們的優點和缺點。表1總結了這些信息。其它替代方法包括印跡法、毛細管電泳法(CE)、酶法 (如酶聯免疫吸附試驗 (ELISA) )、高效液相色譜法(HPLC)、氣相色譜法和SDS-PAGE。蛋白質組學分析也被提議作為評估復雜原材料 (如血清) 的工具。蛋白質組學技術用于了解細胞培養過程中對生長特性影響的批次間可變性。作為該方法的延伸,蛋白質組學與代謝組學相結合已被用于確定細胞培養過程中生產力低下的根本原因。該分析將觀察到的細胞培養性能下降的因素歸結為由于Cu水平升高 (作為培養基成分中的污染物) 而導致的缺氧。
統計在數據分析中的作用
來自生物制藥生產的數據集,包括光譜工具,通常很復雜,因此單變量或雙變量分析是不充分的,并且可能導致錯誤的結論。在大多數情況下,需要使用多元數據分析 (MVDA) 來描述大型多因素和多重共線數據集中的相關信息。MVDA 涉及使用工具進行探索性數據分析(數據挖掘)、分類(聚類分析)、回歸分析和預測建模。投影方法通常用于克服數據集的多維性、多重共線性、缺失數據以及由偏差因素(例如實驗誤差和噪聲)引入的其它變化。一種這樣的技術是主成分分析 (PCA),它通過分解數據集的協方差矩陣來找到數據集中的主要可變性方向,以用幾個組件解釋整個系統的行為。當需要探索一個或多個響應變量的多元相關性時,會使用各種回歸技術,如主成分回歸、偏最小二乘法 (PLS) 和嶺回歸。PLS 通過減小它們的大小、同時最大化它們之間的協方差,來重新排列過程變量空間和響應變量空間。原材料庫的特征數據可能包括一個或多個分類響應變量,這需要使用 PLS 的一種變體,稱為 PLS 判別分析 (PLSDA) 。連續變量數據包含預測信息和不相關信息,使用正交 PLS (OPLS) 可以改進模型的診斷和解釋性。基于 PLS 和 PCA 的批量建模常用于生物技術行業處理批次操作數據。
實驗設計 (DoE) 是規劃實驗研究的選擇方法,這樣可以使用最少數量的實驗來獲得相關的過程信息。它提供了有關因素相互作用和整個系統行為方式的信息。它顯示了相互關聯的因素如何在一個廣泛的值范圍內響應,而不需要直接測試所有可能的值。因此,它在不影響結果質量的情況下減少了進行許多運行的工作量和成本。
MVDA為光譜數據分析提供了一種有效的方法。應用包括預處理方法,以減少和糾正光譜數據中的干擾,如重疊帶、基線漂移、散射和路徑長度變化。還可采用統計方法進行校準診斷和變量選擇,統計結果計算以建立具有代表性和可靠性的模型,并對模型進行驗證和集成,以實現嚴格的預測和實時的產品質量和過程監測。
原材料指紋識別的最新趨勢
在最近的研究中,光譜學和化學計量學的結合被用來表征原材料的可變性,并根據原材料的信息預測最終產品的質量。由于細胞培養原材料是復雜的混合物,因此很難識別和量化存在的每種化合物。拉曼、中紅外、近紅外和熒光等光譜工具與化學計量學相結合,足以表征復雜的原材料。NIR 光譜與 PCA 相結合已被證明可有效地對細胞培養基組分進行指紋識別,從而區分性能好和差的培養基批次。在 Lee 等人最近的另一項研究中,分析了多個大豆水解產物批次的 NIR 光譜,并通過使用化學計量學方法表明,NIR 光譜可用于揭示批次之間以及供應商之間的差異。利用近紅外光譜建立了基于偏最小二乘回歸(PLSR)的哺乳動物細胞培養物生長和產率預測模型。
此外,在確定新原材料對細胞培養性能的影響時,評估多個光譜平臺的性能是很重要的。有研究表明,近紅外光譜和2D熒光光譜都可以檢測基礎培養基的成分變化,發現基礎培養基的老化會影響細胞培養性能,因此近紅外光譜和2D熒光光譜都可以評估基礎培養基儲存后的質量。另一項類似的研究表明,近紅外和2D熒光光譜能夠檢測培養基成分的批次差異。
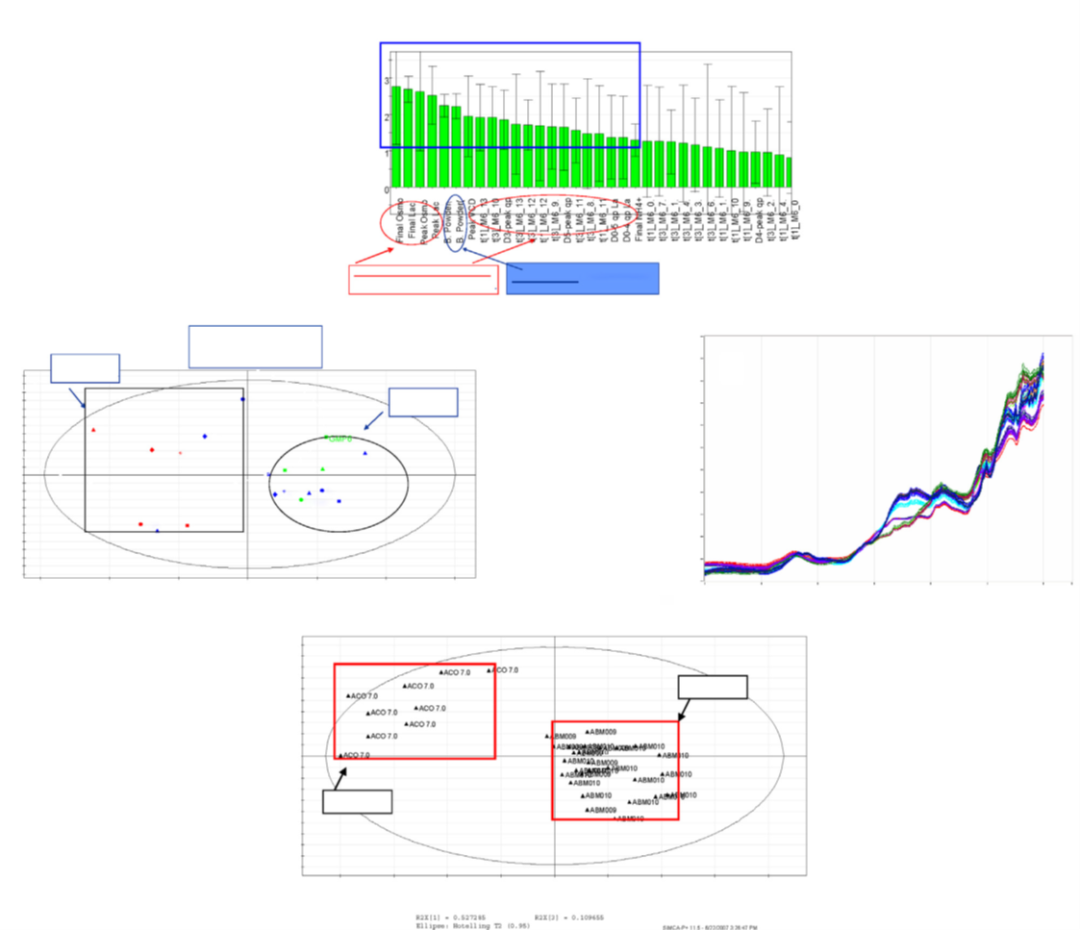
QbD范式下原材料管理的案例研究。(a) 多變量數據分析表明臨床生產 (組2) 和商業化生產 (組1) 存在差異。(b) 根本原因分析表明基礎培養基的差異是工藝可變性的主要來源。(c) 基于近紅外光譜的原材料指紋識別方法的開發。(d) 近紅外光譜法能夠區分“好” (組B) 和“壞”(組A)的批次。
研究人員認為,在很多情況下,單一光譜可能不足以表征原材料,可能需要結合多種正交光譜技術來實現所需的特異性和準確性。已經提出了光譜和非光譜技術的多種組合來表征復雜的原材料。研究人員已經展示了使用氣相色譜-質譜分光光度法 (GC-MS) 方法對復雜的無血清細胞培養基中的脂質進行微量定量,確定為脂肪酸甲酯 (FAME) 。其他研究人員建議結合使用親和層析(Protein G 或Protein A)、SDS-PAGE 和肽質量指紋圖譜來分析細胞培養基中是否存在污染性牛抗體。液相色譜-質譜 (LC-MS) 技術也已應用于多種培養基成分的同步定量。最近,研究還探索了基于化學計量學的數據融合方法,以支持的不同光譜工具的組合。在一項這樣的研究中,多個光譜平臺(NIR、拉曼、熒光和 X 射線熒光)在估計能力方面相互比較,然后集成到一個統一的預測模型中。結果表明,數據融合模型比單獨的光譜方法表現出更好的預測準確性,證明了數據融合在表征原材料質量方面的協同效應。
原材料指紋識別的案例研究
來自一家大型生物技術公司的研究人員報告了一個哺乳動物細胞培養從臨床規模 (2,000 L)到商業化規模(15,000 L)的技術轉移和規模放大過程中面臨的重大問題。該案例研究如圖2所示。商業規模生產的產品的CQA與臨床規模生產的CQA有顯著差異。進行了廣泛的調查,以確定根本原因。根本原因被確定為同一供應商為兩種操作規模提供的基礎培養基的差異。在供應商現場的進一步調查得出的信息是,在碾磨和混合過程中,培養基成分的分組隨生產規模和培養基類型而變化,從而產生不同的特征。考慮到原材料的顯著影響,基于對工藝性能和產品屬性的影響,創建了一種基于近紅外的方法來篩選大量基礎培養基粉末。結合NIR/MVDA方法可以對原材料進行指紋識別,以區分表現良好和表現不佳的培養基批次。
總結
監管反饋導致生物制藥行業對原材料及其管理的看法發生了重大轉變。大多數主要制造商正在應用風險分析和良好科學的原則來確定關鍵原材料及其分析特性。在過去十年中,對關鍵原材料進行準確指紋識別的概念也得到了發展。本文中提出的在QbD范式中逐步管理原材料的方法可能會大大提高我們對該主題的理解。盡管在過去十年中已經取得了很多成就,但我們在原材料表征方面仍然遠遠沒有達到與我們在工藝表征方面相同的嚴格程度。不斷向系統中添加新的原材料將使這項任務仍具挑戰性。
原文:A.S.Rathore, D.Kumar, N. Kateja, Role of raw materials in biopharmaceutical manufacturing: risk analysis and fingerprinting. Current Opinion in Biotechnology, 2018.






